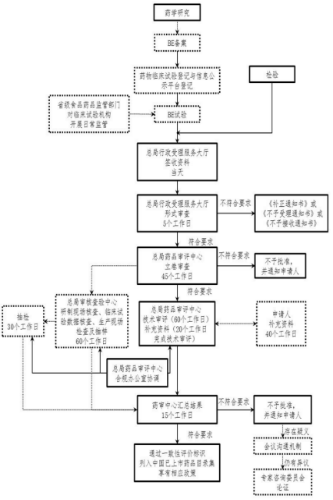
CFDA发布一致性评价申报流程
发布时间: 2017-06-13 09:10 来源:山东福瑞达医药集团办公室 浏览次数: 5020
6月9日,《关于仿制药质量和疗效一致性评价工作有关事项的公告(征求意见稿)》《仿制药质量和疗效一致性评价受理审查指南(需一致性评价品种)(征求意见稿)》《仿制药质量和疗效一致性评价受理审查指南(境内共线生产并在欧美日上市品种)(征求意见稿)》同时在CFDA官网挂出,意见征求时间截止7月9日。
《关于仿制药质量和疗效一致性评价工作有关事项的公告》对参比制剂、BE试验、原研地产化品种、欧美日上市品种、一致性评价申报、一致性评价审评等相关问题进行了明确;《仿制药质量和疗效一致性评价受理审查指南(需一致性评价品种)》《仿制药质量和疗效一致性评价受理审查指南(境内共线生产并在欧美日上市品种)》则详细列出了一致性评价申报资料要求、申报资料审查要点等信息。
仿制药质量和疗效一致性评价工作流程图